11. Sınıf E Kare Kimya Ders 176-177-178-179-180-181 Cevapları

4. Ünite Değerlendirme Soruları
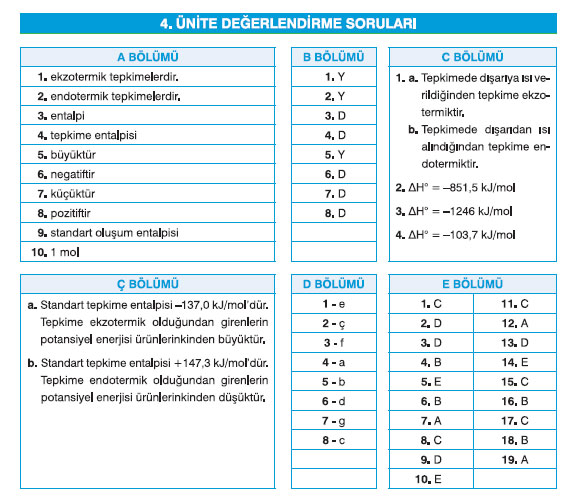
A- Aşağıdaki metinde numaralandırılmış boşlukları kutuda verilen kelimlerden uygun olanları ile tamamlayınız.
Bir yakıttaki ya da gıdadaki kimyasal enerji, moleküllerin düzenlenmelerine bağlı olarak atomlarda depolanmış potansiyel enerjiden ileri gelir. Maddeler kimyasal değişimlere maruz kaldığında depolanmış bu enerji ısı şeklinde dışarıya verilir. Dışarıya ısı vererek gerçekleşen tepkimeler ekzotermik tepkimelerdir(1). Bazı tepkimelerin gerçekleşmesi için dışarıdan enerji gerekir. Dışarıdan ısı alarak gerçekleşen tepkimeler endotermik tepkimelerdir (2). Sabit basınç altında kimyasal tepkimelerde ısı alışverişi entalpi (3) adı verilen nicel bir özellikle izlenir. Entalpi değeri doğrudan ölçülemez. Ancak bir kimyasal tepkimede dışarıya verilen veya dışarıdan alınan ısı enerjisi tepkime entalpisi (4) olarak hesaplanabilir. Ekzotermik tepkimelerde girenlerin potansiyel enerjisi ürünlerin potansiyel enerjisinden büyüktür (5). Dolayısıyla potansiyel enerji farkı kadar bir enerji dışarıya ısı olarak verilir. Dışarıya verilen ısı miktarı ekzotermik tepkimenin entalpisidir. Ekzotermik tepkimelerde ΔH değerinin işareti negatiftir (6). Endotermik tepkimelerde ise girenlerin potansiyel enerjisi ürünlerin potansiyel enerjisinden küçüktür (7). Dolayısıyla potansiyel enerji farkı kadar enerji dışarıdan ısı olarak alınır. Dışarıdan alınan ısı miktarı endotermik tepkimenin entalpisidir. Endotermik tepkimelerde ΔH değerinin işareti pozitiftir (8). Birçok kimyasal tepkime gerçekleşmektedir. Her bir tepkimenin entalpi değişimlerinin deneysel olarak belirlenip tepkimelerde verilmesi uygulamada pratik olmadığı gibi mümkün de değildir. Bunun yerine kimyacılar standart oluşum entalpisi (9) olarak adlandırılan referans bir nokta belirlediler. Standart oluşum entalpileri kullanılarak standart tepkime entalpileri hesaplanabilmektedir. Kimyasal tepkimeler gerçekleşirken bazı kimyasal bağların kırılması ve oluşması sırasında enerji değişimleri söz konusudur. Bu enerjinin miktarı kimyasal bağın kuvveti ile yakından ilişkilidir. Kimyasal bağın kuvveti bağ enerjisiyle ölçülür. Bağ enerjisi standart şartlarda gaz hâlindeki bir molekülde 1 mol (10) kimyasal bağı kırmak için gerekli olan enerji miktarıdır. Bağ enerjisi aynı zamanda bir molekülün kararlılığının da bir ölçüsüdür.
B- Aşağıda verilen ifadeleri okuyunuz. İfadeler doğru ise "D" yanlış ise "Y" harfini işaretleyiniz.
1. Kömürün yanması endotermik tepkimedir. (Y)
2. 2NH3(g) + 92 kJ —* N2(g) + 3H2(g) tepkimesine göre amonyak gazının potansiyel enerjisi, azot ve hidrojen gazlarının toplam potansiyel enerjisinden büyüktür. (Y)
3. Bir kimyasal tepkimede dışarıya ısı veriliyorsa tepkimenin entalpisi sıfırdan küçüktür. (D)
4. Kimyasal tepkimelerde standart şartlar, 1 atmosfer basınçta ve belirli bir sıcaklıktaki (genellikle 25 °C veya 298 K) şartlardır. (D)
5. Standart tepkime entalpisi hesaplanırken girenlerin standart oluşum entalpilerinin toplamından ürünlerin standart oluşum entalpilerinin toplamı çıkarılır. (Y)
6. Gaz fazında gerçekleşen tepkimelerin entalpileri bağ enerjilerinden yararlanarak hesaplanabilir. (D)
7. Elementlerin standart şartlarda oluşum entalpileri sıfır (0) kabul edilir. (D)
8. Birden fazla basamaklar üzerinden gerçekleşen tepkimede basamaklardaki tepkimelerin toplamı, net tepkime denklemini verir. (D)
C- Aşağıdaki soruları cevaplayınız.
1. Aşağıdaki tepkimelerin ekzotermik ya da endotermik olmasını ısı alışverişiyle ilişkilendirerek açıklayınız.
a) CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) ΔH° = –890,3 kJ
Cevap: Tepkimede dışarıya ısı verildiğinden tepkime ekzotermiktir.
b) C2H5OH(s) → C2H4(g) + H2O(s) ΔH° = +44 kJ
Cevap: Tepkimede dışarıdan ısı alındığından tepkime endotermiktir.
2. 2Al(k) + 3/2O2(g) → Al2O3(k) ΔH°ol = –1675,7 kJ/mol
2Fe(k) + 3/2O2(g) → Fe2O3(k) ΔH°ol = –824,2 kJ/mol
Yukarıda verilen tepkimelerin standart oluşum entalpilerinden yararlanarak aşağıdaki net tepkimenin standart entalpi değişimini hesaplayınız.
Cevap: ΔH° = –851,5 kJ/mol
2Al(k) + Fe2O3(k) → Al2O3(k) + 2Fe(k)
3. Tablo 4.3.1’deki (s. 168) bağ enerjilerini kullanarak aşağıda açık formülü verilen tepkimenin entalpisini hesaplayınız.
Cevap: ΔH° = –1246 kJ/mol
4. C3 H8(g) + 5O2(g) → 3CO2(g) + 4H2O(s) ΔH° = –2220,0 kJ/mol
C(k) + O2(g) → CO2(g) ΔH° = –393,5 kJ/mol H2
(g) + 1/2O2(g) → H2O(s) ΔH° = –285,8 kJ/mol
Yukarıda verilen tepkimelerin standart tepkime entalpilerinden yararlanarak aşağıdaki net tepkimenin standart entalpi değişimini hesaplayınız.
3C(k) + 4H2(g) → C3H8(g)
Cevap: ΔH° = –103,7 kJ/mol
Ç. Tablo 4.2.1’deki (s. 163) verileri kullanarak aşağıdaki tepkimelerin standart tepkime entalpilerini hesaplayınız. Tepkimelerin potansiyel enerji-tepkime koordinatı grafiklerini çiziniz. Tepkimelerin ekzotermik ya da endotermik oluşunu tepkime entalpisini kullanarak grafikler üzerinden yorumlayınız.
a) C2H4(g) + H2(g) → C2H6(g)
Cevap: Standart tepkime entalpisi –137,0 kJ/mol’dür. Tepkime ekzotermik olduğundan girenlerin potansiyel enerjisi ürünlerinkinden büyüktür.
b) 2NO2(g) → 2NO(g) + O2(g)
Cevap: Standart tepkime entalpisi +147,3 kJ/mol’dür. Tepkime endotermik olduğundan girenlerin potansiyel enerjisi ürünlerinkinden düşüktür.
D- Aşağıda verilen ifadeleri kavramlarla eşleştiriniz.
| İfade | Kavram |
|---|---|
| 1. Belirli hâldeki bir maddenin standart şartlarda kendisini elementlerinden oluşturan entalpi değişimidir. | e. Standart oluşum entalpisi |
| 2. Basamaklardan oluşan net tepkimenin entalpi değişimi, basamakların entalpi değişimlerinin toplamına eşittir. | ç. Hess Yasası |
| 3. Sabit basınçta ısı alışverişini izlemeye imkân sağlayan nicel özelliktir. | f. Entalpi |
| 4. Standart şartlarda gaz hâlindeki bir molekülde 1 mol kimyasal bağı kırmak için gerekli olan enerji miktarıdır. | a. Bağ enerjisi |
| 5. Dışarıdan ısı alarak gerçekleşen tepkimelerdir. | b. Endotermik tepkimeler |
| 6. Kimyasal bir tepkimede dışarıya verilen veya dışarıdan alınan ısı enerjisidir. | d. Tepkime entalpisi |
| 7. Dışarıya ısı vererek gerçekleşen tepkimelerdir. | g. Ekzotermik tepkimeler |
| 8. 1 atmosfer basınç ve belirli bir sıcaklık (genellikle 25 °C) şartlarıdır. | c. Standart şartlar |
E- Aşağıda verilen çoktan seçmeli soruları cevaplayınız




Yorumların her türlü cezai ve hukuki sorumluluğu yazan kişiye aittir. Eğitim Sistem yapılan yorumlardan sorumlu değildir.