11. Sınıf Kimya Ders Kitabı Ders 268-269-270-271-272-273 Cevapları E Kare Yayıncılık

6. Ünite Değerlendirme Soruları
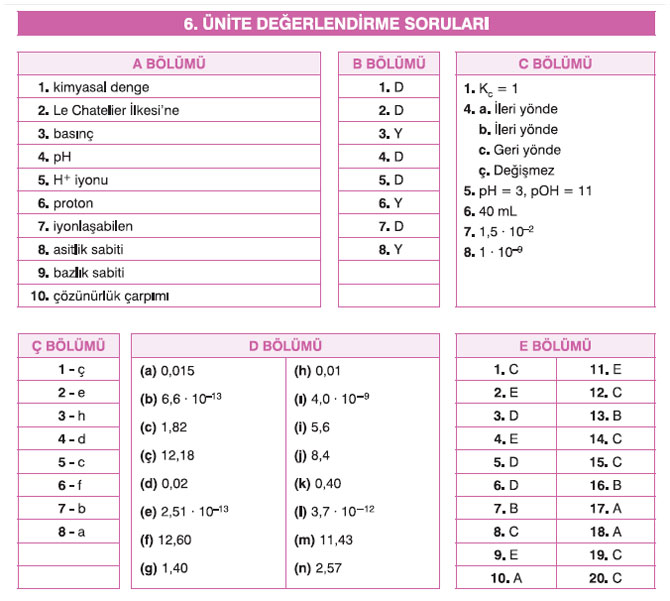
A- Aşağıdaki metinde numaralandırılmış boşlukları kutularda verilen kelime ya da kelime grubundan uygun olanla tamamlayınız.
Kimyasal tepkimelerin bazıları tek yönlü olmakla birlikte birçoğu hem ileri hem de geri yönlü yani tersinir tepkimelerdir. Bu tür tepkimelerde ileri yöndeki tepkimenin hızı, geri yöndeki tepkimenin hızına eşit olduğu anda kimyasal denge (1) kurulur. Denge hâlindeki bir sisteme dışarıdan bir etki yapıldığında, Le Chatelier İlkesi’n (2) göre sistem bu etkiyi azaltacak yönde hareket eder ve yeniden dengeye ulaşır. Dengeye derişim, basınç (3), hacim ve sıcaklık gibi faktörler etki eder. Kimyasal tepkimelerin en önemli sınıflarından birini sulu çözeltilerde gerçekleşen asit-baz tepkimeleri oluşturur. Bu tepkimelerde derişimleri nicel olarak ifade edebilmek için pH (4) kavramı kullanılır. Farklı şekillerde asit ve baz tanımı yapmak mümkündür. Hatırlanacağı gibi Arrhenius tanımı, suda çözündüğünde proton (5) veya OH– iyonu oluşturmasına göre yapılan tanımdır. Biraz daha kapsamlı bir tanım olan Brønsted-Lowry asit-baz tanımı, H+ iyonu (6) alışverişine göre yapılan tanımdır. Asit ve bazlar, suda çözündüğünde iyonlaşabilen maddelerdir. Dolayısı ile bir asidin veya bir bazın kuvvetli olup olmamasının ölçüsü, suda ne kadar iyonlaşabildiği ile ilgilidir. Suda çözündüğünde tamamen iyonlaşabilen (7) asitler kuvvetli asitler, bazlar ise kuvvetli bazlardır. Tersine, suda çözündüğünde kısmen iyonlaşabilen asitler zayıf asitler, bazlar ise zayıf bazlardır. Zayıf asitlerin iyonlaşma denge tepkimeleri, asitlik sabiti (8) denilen “Ka”, zayıf bazların iyonlaşma denge tepkimeleri ise bazlık sabiti (9) denilen “Kb” değerleri ile ifade edilir. Belirli bir sıcaklıkta “Ka” ve “Kb” değeri arttıkça zayıf asidin ve zayıf bazın kuvveti de artar. Zayıf asit ve bazlarda olduğu gibi az çözünen tuzların çözünürlük denge tepkimeleri de çözünürlük çarpımı (10) denilen “Kçç” ile ifade edilir.
B. Aşağıda verilen ifadeleri okuyunuz. İfadeler doğru ise “D”, yanlış ise “Y” harfini işaretleyiniz.
1. Katı ve sıvı maddelerin derişimleri sabit olduğundan denge denklemlerinde yer almaz. (D)
2. Denge hâlindeki bir tepkimeye giren maddelerden biri eklendiğinde net tepkime ürünler yönüne ilerler. (D)
3. “Ka” değeri büyük olan zayıf bir asidin konjuge bazının “Kb” değeri de büyüktür. (Y)
4. Denge sabiti “Kc”nin değeri sıcaklıkla değişir. (D)
5. Dinamik denge, gözlenebilir olayların sonlandığı, gözlenemeyen olayların devam ettiği bir süreçtir. (D)
6. Basınç artışına bağlı olarak gazların çözünürlüğü azalır. (Y)
7. Kuvvetli asit ve bazların iyonlaşma yüzde oranı, zayıf asit ve bazların iyonlaşma yüzde oranlarından büyüktür. (D)
8. Bir maddenin asit olup olmadığı, molekülünde hidrojen atomunun olup olmadığına bakılarak belirlenir. (Y)
Aşağıdaki soruları cevaplayınız.
1. Fiziksel ve kimyasal denge nedir? Aralarındaki farkı birer örnekle açıklayınız.
Cevap: Kc = 1
2. Aşağıdaki tepkimelerin denge denklemlerini derişimler ve kısmi basınçlar türünden yazınız.
a) 2SO2(g) + O2(g) E 2SO3(g) b) MgCO3(k) E MgO(k) + CO2(g)
3. C(k) + CO2(g) E 2CO(g) Belirli bir sıcaklıkta 2 L’lik kapalı bir kaba 4 mol C katısı ve 3 mol CO2 gazı konularak yukarıdaki tepkime gerçekleşiyor. Buna göre dengedeki tepkimenin Kc değeri kaçtır?
4. 3O2(g) + 284,2 kJ E 2O3(g) tepkimesine aşağıdaki işlemler uygulandığında net tepkimenin yönünü belirleyiniz.
a) O2 eklenmesi durumunda
Cevap: İleri yönde
b) Sıcaklığın artırılması durumunda
Cevap: İleri yönde
c) Basıncın azaltılması durumunda
Cevap: Geri yönde
ç) Katalizör eklenmesi durumunda
Cevap: Değişmez
5. Bir asit çözeltisinden alınan numunenin H+ iyonları derişimi 1 ∙ 10–3 mol/L’dir. Buna göre çözeltinin pH ve pOH değerleri kaçtır?
Cevap: pH = 3, pOH = 11
6. 0,5 M’lık HCl çözeltisi ile 0,2 M’lık 100 mL NaOH çözeltisi titre ediliyor. Tepkimenin sonlanma noktasında kaç mL HCl çözeltisi harcanır?
Cevap: 40 mL
7. 25 °C’ta “Kçç” değeri 1,4 ∙ 10–5 olan Ag2SO4 katısının sudaki çözünürlüğünü hesaplayınız.
Cevap: 1,5 ∙ 10–2
8. 25 °C’ta CaF2’ün çözünürlük çarpımı “Kçç” değeri 4,0 ∙ 10–11 dir. Buna göre CaF2’ün 0,2 M NaF çözeltisindeki molar çözünürlüğünü hesaplayınız.
Cevap: 1 ∙ 10–9
Aşağıda verilen ifadeleri kavramlarla eşleştiriniz.
Çizelgede çözelti türlerine ilişkin verilen sayısal değerleri kullanarak yay ayraç içindeki rakamların bulunduğu yerlere gerekli hesaplamaları yaparak istenilen sayısal değerleri yazınız. (HCN için Ka = 6,2 ∙ 10−10, NH3 için Kb = 1,8 ∙ 10−5, log(0,015) = 1,82, log(0,04) = 1,40, log(2,5 ∙ 10−6) = 5,60, log(2,7 ∙ 10−3) = 2,57.
Aşağıda verilen çoktan seçmeli soruları cevaplayınız.
1. Aşağıdaki tepkimelerin hangisinde maksimum düzensizlik eğilimi ürünler yönünedir?
A) H2O(g) m H2O(s)
B) Ag+(suda) + Cl–(suda) m AgCl(k)
C) 2NO2(g) m 2NO(g) + O2(g)
D) CO2(g) m CO2(suda)
E) CaO(k) + CO2(g) m CaCO3(k)
Cevap: C
2. Denge hâlindeki bir tepkime için;
I. Dinamik bir dengedir.
II. İleri ve geri tepkime hızları eşittir.
III. Girenlerin ve ürünlerin derişimleri sabittir.
ifadelerinden hangileri doğrudur?
A) Yalnız III B) I ve II C) I ve III D) II ve III E) I, II ve III
Cevap: E
3. 2 L’lik bir kaba 0,4 mol S2 ve 0,6 mol H2 gazları konularak aşağıdaki denge tepkimesi kuruluyor. S2 (g) + 2H2(g) m 2H2S(g) Dengede 0,2 mol S2 gazı bulunduğuna göre dengedeki tepkimenin Kc değeri kaçtır?
A) 5 B) 10 C) 20 D) 40 E) 50
Cevap: D
4. 2NO(g) + O2(g) m 2NO2(g) tepkimesine ait Kp ve Kc değerleri arasındaki eşitlik aşağıdakilerden hangisidir?
A) Kp = Kc
B) Kp = Kc (RT)
C) Kp = Kc (RT)2
D) Kp = Kc (1/RT)2
E) Kp = Kc (1/RT)
Cevap: E
5. Aşağıdaki hangi tepkime için Kp = Kc’dir?
A) 2Na2O2(k) + 2CO2(g) m 2Na2CO3(k) + O2(g)
B) CO(g) + 2H2(g) m CH3OH(g)
C) NH4NO3(k) m N2O(g) + 2H2O(g)
D) S(k) + CO(g) m COS(g)
E) CH4(g) + H2O(g) m CO(g) + 3H2(g)
Cevap: D
6. H2(g) + I2(g) → 2HI(g) Belirli sıcaklıkta 1 L’lik kapalı bir kaba ikişer mol H2 ve I2 konularak yukarıdaki denge tepkimesi kuruluyor. Tepkimenin denge sabiti Kc = 4 olduğuna göre dengede HI gazının derişimi kaç mol/L’dir?
A) 0,2 B) 0,4 C) 1 D) 2 E) 4
Cevap: D
7. 2SO2(g) + O2(g) → 2SO3(g) + 197,8 kJ Tepkimesi belirli sıcaklıkta kapalı bir kapta dengede iken sisteme aşağıdaki işlemler uygulanıyor.
I. Basınç artırılıyor.
II. Sıcaklık azaltılıyor.
III. Kaba SO3 gazı ekleniyor.
Buna göre uygulanan hangi işlem ya da işlemlerde net tepkime ürünler yönüne ilerler?
A) Yalnız II B) I ve II C) I ve III D) II ve III E) I, II ve III
Cevap: B
8. Denge hâlindeki bir sistemin “Kc” değerini aşağıdaki işlemlerden hangisi değiştirir?
A) Katalizör eklemek
B) Basıncı değiştirmek
C) Sıcaklığı değiştirmek
D) Ürünlerin derişimini azaltmak
E) Girenlerin derişimini artırmak
Cevap: C
9. Belirli sıcaklıkta OH– iyonları derişimi 0,001 M olan çözeltinin pH değeri kaçtır?
A) 1 B) 3 C) 7 D) 9 E) 11
Cevap: E
10. I. 0,01 M HCl çözeltisi
II. 0,01 M NH3 çözeltisi
III. 0,01 M NaOH çözeltisi
Yukarıdaki çözeltilerin pH değerlerinin büyüklükleri bakımından karşılaştırılması aşağıdakilerin hangisinde doğru olarak verilmiştir.
(NH3 için Ka = 1,8 ∙ 10−5)?
A) III > II > I B) III > I > II C) II > III > I D) II > I > III E) I > III > II
Cevap: A
11. HNO2(suda) + H2O(s) m NO2 –(suda) + H3O+(suda) denge tepkimesine göre
I. NO2 – proton alır.
II. HNO2 asit olarak davranır.
III. H2O ve H3O+ konjuge asit baz çiftidir.
ifadelerinden hangileri doğrudur?
A) Yalnız III B) I ve II C) I ve III D) II ve III E) I, II ve III
Cevap: E
12. HClO4(suda) + H2O(suda) ClO– 4(suda) + H3O+(suda) Yukarıda verilen denge tepkimesinin belirli sıcaklıkta “Ka” değeri 1 . 10–4 tür. 0,01 M HClO4 çözeltisinin iyonlaşma yüzde oranı kaçtır?
A) 2 B) 5 C) 10 D) 15 E) 20
Cevap: C
13. Aşağıdaki sistemlerden hangisi tampon çözelti oluşturur?
A) HF / HBr
B) F– / HF
C) NaCl / KCl
D) HCl / NaOH
E) NH3 / H2O
Cevap: B
14. 0,2 M’lık 150 mL HNO3 çözeltisi 0,3 M NaOH çözeltisi ile titre ediliyor. Tepkimenin eş değerlik noktasında kaç mL NaOH çözeltisi harcanır?
A) 300
B) 200
C) 100
D) 50
E) 25
Cevap: C
15. HCN(suda) + H2O(s) m CN–(suda) + H3O+(suda) Yukarıdaki denge tepkimesine göre 0,1 M HCN çözeltisindeki H3O+ iyonlarının derişimi kaç molardır (HCN için Ka = 6,2 ∙ 10–10)
A) 6,2 ∙ 10–8
B) 3,4 ∙ 10–7
C) 7,9 ∙ 10–6
D) 5,6 ∙ 10–5
E) 8,4 ∙ 10–4
Cevap: C
16. HNO2(suda) + H2O(s) m NO2 –(suda) + H3O+(suda) Yukarıdaki denge tepkimesine göre 0,02 M HNO2 çözeltisinin pH değeri kaçtır (HNO2 için Ka = 4,5 ∙ 10–4, log 3 = 0,5)
A) 1,0 B) 2,5 C) 3,2 D) 4,6 E) 25
Cevap: B
17. CaBr2(k) Ca2+(suda) + 2Br –(suda) Yukarıdaki tepkimenin çözünürlük denge sabiti ifadesi aşağıdakilerden hangisidir?
A) Kçç = [Ca2+] [Br –]2
B) Kçç = [Ca2+]2 [Br –]
C) Kçç = [Ca2+] [Br –]
D) Kçç = [Ca2+] 2[Br –]
E) Kçç = [CaBr2]
Cevap: A
18. 25 °C’ta BaCO3 tuzunun “Kçç” değeri 8,1 . 10–9 dur. Buna göre BaCO3 tuzunun çözünürlüğü kaç mol/L’dir?
A) 9 ∙ 10–5 B) 3 ∙ 10–6 C) 5 ∙ 10–8 D) 4 ∙ 10–10 E) 6 ∙ 10–12
Cevap: A
19. Az çözünen bir tuz için;
25 °C’ta Kçç = 3,1 ∙ 10–8
30 °C’ta Kçç = 5,4 ∙ 10–8
olduğuna göre;
I. Tuzun çözünmesi endotermiktir.
ll. Sıcaklık arttığında iyonların derişimi de artar.
lll. Sıcaklık arttığında çözünürlük dengesi girenler yönüne ilerler.
ifadelerinden hangileri doğrudur?
A) Yalnız II B) Yalnız III C) I ve II D) I ve III E) II ve III
Cevap: C
20. 25 °C’ta PbCl2’ün 0,02 M NaCl çözeltisindeki çözünürlüğü 4 ∙ 10–5 M’dır. PbCl2’ün çözünürlük çarpımı kaçtır?
A) 6,4 ∙ 10–13
B) 3,2 ∙ 10–11
C) 1,6 ∙ 10–8
D) 8 ∙ 10–7
E) 2 ∙ 10–3
Cevap: C





Yorumların her türlü cezai ve hukuki sorumluluğu yazan kişiye aittir. Eğitim Sistem yapılan yorumlardan sorumlu değildir.