11. Sınıf E Kare Kimya Ders 52-57 Cevapları

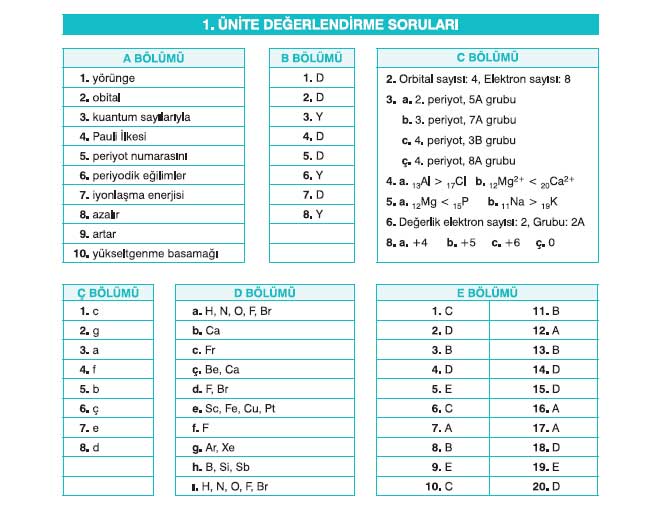
1. Ünite Değerlendirme Soruları
A- Aşağıdaki metinde numaralandırılmış boşlukları kutuda verilen kelimelerden uygun olanları ile tamamlayınız.
Elektronun bulunabileceği enerji düzeyleri Bohr atom modelinde yörünge (1) kavramı ile tanımlanırken atomun kuantum modelinde orbital (2) kavramı ile tanımlanır. Orbital, kuantum sayılarıyla (3) tanımlanan bir dalga fonksiyonudur ve elektron kuantum sayılarının belirlediği tek bir enerji düzeyinde bulunur. Belirli şekilleri ve uzayda yönelişlerinin olduğu varsayılarak dört orbital türü tanımlanmıştır. Bunlar s, p, d ve f orbitalleridir. Nötr atomların elektron dizilimleriyle periyodik sistemdeki yerleri arasında bir ilişki söz konusudur. Bu ilişki Hund Kuralı, Pauli İlkesi (4) ve Aufbau Prensibi ile açıklanır. Bir element atomunun elektron diziliminde en yüksek enerji düzeyi periyot numarasını (5), sonlandığı orbital türü grubunu, değerlik elektron sayısı ise kaçıncı grupta olduğunu belirtir. Periyodik tablo, elementlerin artan atom numaralarına göre sıralanarak oluşturulmuştur. Elementlerin fiziksel ve kimyasal özellikleri de atom numaralarına bağlı olarak periyodik eğilimler (6) gösterir. Bu eğilimler; atom/iyon yarıçapı, iyonlaşma enerjisi (7), elektron ilgisi, elektronegatiflik, metalik/ametalik eğilimler, oksit/ hidroksit bileşiklerinin asitlik/bazlık eğilimleridir. Periyodik tabloda periyot boyunca soldan sağa doğru gidildikçe atom yarıçapı, metalik özellik ve oksitli bileşiklerin bazlık özelliği azalır (8), iyonlaşma enerjisi, elektronegatiflik ve oksitli bileşiklerin asitlik özelliği artar (9). Periyodik tabloda gruplar boyunca yukarıdan aşağıya doğru inildikçe atom yarıçapı, metalik özellik ve hidroksitli bileşiklerin bazlık özelliği artar, iyonlaşma enerjisi, elektronegatiflik ve hidroksitli bileşiklerin asitlik özelliği azalır. Kimyasal tepkimelerde bileşikler oluşurken atomlar arasında alınan veya verilen elektron sayısı yükseltgenme basamağı (10) olarak adlandırılır. Geçiş metallerinin çoğunluğu birden fazla yükseltgenme basamağına sahiptir.
B- Aşağıda verilen ifadeleri okuyunuz. İfadeler doğru ise "D" yanlış ise "Y" harfini işaretleyiniz.
(D) 1. Kuantum sayıları elektronun atomdaki enerji düzeylerine göre konumunu tespit eder.
(D) 2. Açısal momentum kuantum sayısı l = 1 olan alt enerji düzeyinde toplam 3 orbital bulunur.
(Y) 3. Bir katyonun iyon yarıçapı oluştuğu atomun yarıçapından büyüktür.
(D) 4. Periyodik tabloda periyot boyunca soldan sağa doğru gidildikçe atom yarıçapı genellikle azalır.
(D) 5. Periyodik tabloda gruplar boyunca yukarıdan aşağıya doğru inildikçe metalik özellik artar.
(Y) 6. Elektron dizilimi 4s23d5 ile sonlanan bir element atomu periyodik tablonun 3. periyot, 5A grubundadır.
(D) 7. d bloku elementleri bileşik oluştururken öncelikle s orbitalindeki değerlik elektronlarını verme eğilimindedir.
(Y) 8. SO2-4 iyonunda S atomunun yükseltgenme basamağı -2’dir.
C- Aşağıdaki soruları cevaplayınız.
1. Yörünge ve orbital kavramları arasındaki farkları açıklayınız.
 Yörünge ve orbital kavramları arasındaki farklar
Yörünge ve orbital kavramları arasındaki farklar
2. n = 2 için toplam orbital sayısı ve bu orbitallerde bulunabilecek en fazla elektron sayısı kaçtır?
Orbital sayısı: 4, Elektron sayısı: 8
3. Aşağıdaki elementlerin periyot ve grup numaralarını belirleyiniz.
a) 7N b) 17Cl c) 21Sc ç) 36Kr
a. 2. periyot, 5A grubu
b. 3. periyot, 7A grubu
c. 4. periyot, 3B grubu
ç. 4. periyot, 8A grubu
4. Aşağıda verilen atom ve iyon çiftlerini yarıçaplarının büyüklüğüne göre karşılaştırınız?
a) 13Al ve 17Cl b) 12Mg2+ ve 20Ca2+
5. Aşağıda verilen atom çiftlerini birinci iyonlaşma enerjilerinin büyüklüğüne göre karşılaştırınız.
a) 12Mg ve 15P b) 11Na ve 19K
6. Aşağıda kJ/mol biriminde iyonlaşma enerjisi verilen kalsiyum (Ca) element atomunun değerlik elektron sayısını bularak periyodik tablodaki grup numarası ile ilişkilendiriniz.
Değerlik elektron sayısı: 2, Grubu: 2A
7. İyon yükü ile yükseltgenme basamağı arasındaki farkı açıklayınız.
Yükseltgenme Basamağı ise bir atomun başka bir atomla birleşerek molekül ya da çok atomlu iyon oluştururken kaybettiği, kazandığı ya da ortaklaşa kullandığı elektron sayısıdır. İyon yükü sadece suda çözünen serbest iyonlar oluşturabilen iyonik bağlı bileşikler için geçerlidir.
İyon Yükü: Bir atomun elektron alması veya vermesi sonucu aldığı değere iyon yükü denir. Bir atom elektron veriyor ise değerliği artıyor demektir.
İyon: (+) veya (–) yüklü atom ya da atom gruplarına iyon denir.
Katyon: (+) yüklü atom ya da atom gruplarına katyon denir. (Na+1, Mg+2, NH4+1, … )
Yükseltgenme Basamağı: Atom grupları içerisinde yer alan elementlerin aldığı veya verdiği elektron sayıları her zaman net değildir. Bu nedenle atom gruplarındaki elementlerin aldığı veya verdiği elektron sayısına yükseltgenme basamağı denir.
Yükseltgenme Basamağı; bir atomun başka bir atomla birleşerek molekül ya da çok atomlu iyon oluştururken kaybettiği, kazandığı ya da ortaklaşa kullandığı elektron sayısıdır. İyon yükü ise sadece suda çözünen serbest iyonlar oluşturabilen iyonik bağlı bileşikler için geçerlidir.
8. Aşağıda verilen kimyasal türlerde istenilen atomların yükseltgenme basamaklarını belirleyiniz.
a) CO2 bileşiğinde C atomunun b) P4O10 bileşiğinde P atomunun
c) Na2SO4 bileşiğinde S atomunun ç) Br2 molekülünde Br atomunun
Ç- Aşağıda verilen ifadeleri kavramlarla eşleştiriniz.
E- Aşağıda verilen çoktan seçmeli soruları cevaplayınız




Yorumların her türlü cezai ve hukuki sorumluluğu yazan kişiye aittir. Eğitim Sistem yapılan yorumlardan sorumlu değildir.