9. Sınıf Evrensel İletişim Kimya Sayfa 131-138 Cevapları

3. ÜNİTE SONUÇ DEĞERLENDİRME
A) Aşağıda verilen cümlelerdeki noktalı yerlere tabloda verilen ifadelerden uygun olanlarını yazınız.
1 dipol-dipol etkileşimi 2 London 3 küçüktür 4 N2O 5 elektron 6 fiziksel 7 40 kJ/mol 8 hidrojen bağı 9 H2O
1. Hidrojen bağı zayıf etkileşimler içinde en kuvvetli etkileşimdir.
2. CH4 bileşiğinin kaynama noktası C3H8 bileşiğinin kaynama noktasından daha küçüktür.
3. HCI molekülleri arasında bulunan zayıf çekim kuvvetlerinden en etkini Dipol-dipol etkileşimi olarak söylenebilir.
4. Bir metalin elektrik akımını iletmesi fiziksel olay olarak tanımlanır.
5. Yanma tepkimelerinde ısı enerjisi değişimi genelde 40 kj/mol değerinden büyüktür.
6. Dihidrojen monoksit sistematik adı ile bilinen bileşiğin kimyasal formülü H2O yapısındadır.
7. CH4 moleküllerinin yoğun hâllerinde moleküller arasında London kuvvetleri bulunur.
8. Apolar moleküllerde, molekülün yapısındaki elektron yoğunluğu arttıkça London kuvvetleri ve bileşiğin kaynama noktası yükselir.
B) Aşağıdaki cümlelerin sonundaki kutucuklara ifade doğru ise “D”, yanlış ise “Y” yazınız.
(Y) 1. Na, Mg, H2, O2 maddelerinde bulunan kimyasal türler atomdur.
(D) 2. Atom numarası 9 olan flor atomunun Lewis yapısı F şeklinde gösterilebilir.
(D) 3. CaO ve Ca(OH)2 bileşiklerinin sistematik adı sırası ile kalsiyum oksit ve kalsiyum hidroksittir.
(D) 4. Türler arası etkileşimin sağlamlığı, o çekim kuvveti oluşurken açığa çıkan enerjinin büyüklüğü ile belirlenir.
(Y) 5. Sodyum iyonu (Na+) ve florür iyonu (F–) kimyasal türlerinin arasında güçlü kovalent bağlar vardır.
(D) 6. H2, O2 ve N2 moleküllerinde atomlar arası etkileşim apolar kovalent bağdır.
(D) 7. CO2 molekülünde iki tane özdeş ikili polar kovalent bağ bulunmasına karşın molekül apolar yapıdadır.
(D) 8. Asal gaz atomları ve apolar yapılı moleküllerin sıvı hâllerinde London çekim kuvvetleri etkindir.
(Y) 9. NH3 molekülleri arasında sadece zayıf çekim kuvvetlerinden hidrojen bağları bulunur.
(D) 10. CaCO3, sistematik adı kalsiyum karbonat olan bileşiğin kimyasal formülüdür
C) Aşağıda verilen cümlelerdeki noktalı yerleri uygun ifadelerle tamamlayınız.
1. H2O molekülünde hidrojen ve oksijen atomları arasında bulunan güçlü çekim kuvvetleri polar kovalent bağdır.
2. Fe(NO3)3 formülündeki bileşiğin sistematik adı demir (III) nitrat tır.
3. CO2 molekülünde bulunan güçlü çekim kuvvetleri polar kovalent, zayıf çekim kuvvetleri ise London etkileşimleridir.
4. Lewis yapısı X Y şeklinde olan bir molekülde bulunan kovalent bağ polar karakter gösterir.
5. C2H6 molekülünde bir tane apolar kovalent bağ, altı tane polar kovalent bağ bulunur.
6. Bir maddenin fiziksel özellikleri, içerdiği kimyasal türler arasında bulunan zayıf etkileşimler tarafından belirlenir.
7. Hidrojen bağı, hidrojen atomunun F, O, N element atomlarından birisi ile kimyasal bağ oluşturduğu moleküllerde görülür.
8. Moleküler yapıdaki kimyasal türlerde, aynı veya farklı en az iki tane atom bulunur.
9. Metal atomlarının katı veya sıvı hâllerinde atomlar arasında bulunan etkileşim metalik bağ dır.
10. HgO ve Hg2O formülündeki bileşiklerin sistematik adları sırası ile cıva (II) oksit ve cıva (I) oksit tir.
D) Aşağıdaki soruları cevaplayınız.
1. Tabloda verilen kimyasal türleri atom, iyon veya molekül olarak belirleyiniz. (1H, 7N, 8O, 20Ca)
| Kimyasal Tür | Atom | İyon | Molekül |
|---|---|---|---|
| N | ✔ | ||
| H2 | ✔ | ||
| H2O | ✔ | ||
| NH3 | ✔ | ||
| OH– | ✔ | ||
| Ca2+ | ✔ |
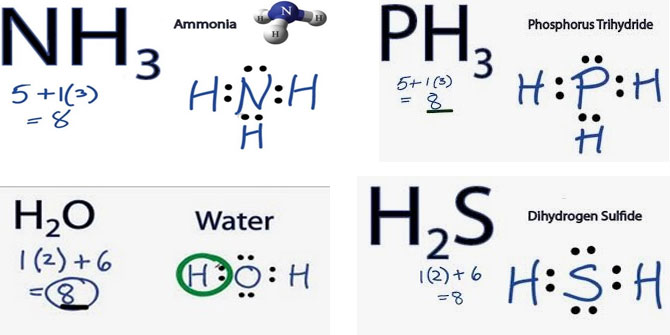
2. NH3 ile PH3, H2O ile H2S kimyasal tür çiftlerinin Lewis yapılarını yazınız. Bulundurdukları güçlü ve
zayıf etkileşimleri karşılaştırınız. (1H, 7N, 8O, 15P, 16S)
3. CH4, HCI ve H2O bileşiklerinde, fiziksel bir özellik olan kaynama noktasını belirleyen zayıf etkileşimler
hangileridir? Açıklayınız. (1H, 6C, 8O, 17Cl)
CH4 - Etkileşim türü: London Kuvvetleri
CH4, SiH4, GeH4 ve SnH4 molekülleri apolar karakterlidir. Kendi molekülleriarasında sadece London kuvvetleri bulunduğundan diğer gruplardaki bileşiklere göre kaynama noktaları düşüktür.
H2O - Etkileşim türü:London Kuvvetleri, dipol dipol etkileşimleri ve hidrojen bağları
Moleküller arasındaki çekim kuvvetleri ne kadar büyük olursa bileşiğin erime noktası, kaynama noktası gibi fiziksel özellikleri de o kadar yüksek olur. Sadece London kuvvetleri bulunduran bileşiklerde genelde kaynama noktaları düşük, London kuvvetleri ve dipol-dipol etkileşimlerini birlikte bulunduran bileşiklerde ise daha büyüktür. London kuvvetleri, dipol-dipol etkileşimleri ve hidrojen bağlarını içeren bileşiklerde ise genelde beklenenden daha yüksek kaynama noktaları çıkar.
HCI - Etkileşim türü:Dipol-dipol etkileşimleri
Polar bir molekül olan HCl molekülünde molekül içi bağlar, polar kovalent bağdır. Molekülün polar karakterinden dolayı moleküller arasında dipol - dipol etkileşimleri oluşur.Bir moleküldeki polarlık ne kadar fazla ise diğer moleküllerle arasında oluşan dipol-dipol etkileşimi o kadar büyük olur. Dipol-dipol etkileşiminin artması ile bileşiğin erime veya kaynama noktası da artar.
4. Tabloda verilen kimyasal türlerin Lewis yapılarını gösteriniz (1H, 9F, 11Na, 17CI, 19K).
Kimyasal Tür F CI– Na+ KF HCI
Lewis Yapısı
5. İyonik bağlı bileşiklerin genel özelliklerini açıklayınız. İyonik bir bileşiğin suda çözünmesi, türler arasındaki hangi çekim kuvvetlerinin oluşması ile gerçekleşir?
Türler arası etkileşimler;
- Güçlü etkileşimler
- Zayıf etkileşimler
olarak ikiye ayrılır.
Güçlü etkileşimler;
- İyonik bağ
- Kovalent bağ
- Metalik bağ
olarak üçe ayrılır.
Zayıf etkileşimler ise iki sınıfa ayrılır.
Bu sınıflar;
- Van Der Walls bağları
- Hidrojen bağları
şeklindedir.
İyonik bağlı bileşikler için şunları söyleyebiliriz;
- İyonik bileşiklerde iyonlar arasında oluşan çekim kuvveti oldukça büyüktür.
- İyonik bağlı bileşiklerin erime ve kaynama noktaları oldukça yüksektir.
- Oda koşullarında katı hâldedirler.
- İyonik katıların büyük bir bölümü suda çözünür.
- İyonik bağlı bileşikler suda çözündüklerinde tamamen iyonlarına ayrışırlar.
- Yemek tuzu gibi katıların suda çözünmesi sırasında maddenin kimliğinde değişme olmaz.
- Çözünme sadece kristaldeki iyonların birbirinden uzaklaşması şeklinde gerçekleşir.
- Katı halde elektrik akımını iletmezler.
- Sulu çözeltileri elektrik akımını iletir.
- Su, yani H2O, polar yapılı bir maddedir. Dolayısıyla iyonik bağlı bir bileşiğin suda çözünmesi olayı, türler arasındaki iyon - dipol çekim kuvvetlerinin oluşması ile gerçekleşir.
6. 19K, 16S, 3Li ve 8O element atomlarını aynı periyotta ve aynı grupta olmalarına göre sınıflandırınız.
Aynı periyotta olanlar: 8O ve 3Li aynı periyotttadır. (2. periyot)
Aynı Grupta olanlar: 16S ve 8O 16. grupta, 19K ve 3Li 1. gruptadır.
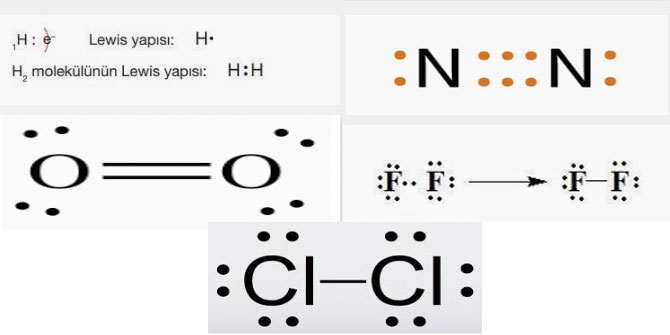
7. H2, N2, O2, F2, CI2 moleküllerinin Lewis yapılarını gösteriniz. Bağların türünü ve polarlığını belirtiniz.
Güçlü etkileşimleri tekli, ikili veya üçlü bağ olarak sınıflandırınız (1H, 7N, 8O, 9F, 17CI).
8. Fiziksel bir değişimdeki ısı enerjisi değişimi kimyasal bir değişimdekinden büyük olabilir mi? Açıklayınız.
Fiziksel değişimde maddelerin sadece fiziksel özellikleri değişir. Parçalanma, kırılma, hal değişim olayları vb. fiziksel değişimlerdir.
Fiziksel değişime örnek olarak aşağıdaki olaylar verilebilir.
- Kağıdın yırtılması,
- Mumun erimesi,
- Camın kırılması,
- Buzun erimesi vb.
Maddelerin fiziksel özellikleri fiziksel değişimle değişirken, kimyasal özelliklerinde herhangi bir değişim gözlenmez. Fiziksel değişimlerin oluşması çoğunlukla zayıf çekim kuvvetlerinin kopması ya da ortaya çıkmasıyla gerçekleşir.
Kimyasal değişimlerde iyonik bileşik ya da kovalent bileşikteki atomlar arasındaki etkileşimlerin kopması ya da oluşması güçlü etkileşimlerdir. Bu nedenle bu etkileşimlerin gerçekleşmesi sırasında enerji değişimleri çoğunlukla 40 kJ/mol’den büyük olur. Örnek olarak, suyun elektrolizi verilebilir.
9. Zayıf çekim kuvvetlerinden London kuvvetleri, dipol - dipol etkileşimleri ve hidrojen bağlarının kimyasal türün fiziksel özelliklerinde hangi durumlarda etkin olduklarını açıklayınız.
London kuvvetleri, indüklenmiş dipol ile indüklenmiş dipol etkileşimleridir. Geçici dipollerin oluşumu asal gazlar ve apolar yapılı kovalent moleküllerin katı ya da sıvı hâllerinde gerçekleşir. London kuvvetleri, meydana gelen bu geçici dipoller arasındaki çekim kuvvetine verilen isimdir.
London kuvvetleri bulunduran bileşiklerde >> Kaynama noktası düşüktür.
London kuvvetlerini ve dipol-dipol etkileşimlerini birlikte bulunduran bileşiklerde >> Kaynama noktası daha büyük olur.
London kuvvetleri, dipol-dipol etkileşimleri ve hidrojen bağlarını içeren bileşiklerde >> Çok daha yüksek kaynama noktası bulunur.
Bir bileşiğin kaynama noktası, erime noktası vb. fiziksel özelliklerinin yüksek olması, moleküller arasındaki çekim kuvvetlerinin büyüklüğüyle doğru orantılıdır.
Bir moleküldeki polarlık ile diğer moleküllerle arasında meydana gelen dipol-dipol etkileşimi doğru orantılıdır. Bir molekülün polarlığının yüksek olması dipol dipol etkileşiminin de yüksek olmasını sağlar.
Bir bileşiğin erime ya da kaynama noktasının artması >> Dipol-dipol etkileşiminin artmasıyla gerekleşir.
10. Magnezyum metalinin erimesi, LPG’nin yanması, yemek tuzunun suda çözünmesi ve sodyum metalinin suda çözünmesi değişimlerini fiziksel ve kimyasal olmalarına göre sınıflandırınız.
1. Magnezyum metalinin erimesi:
Katı haldeki magnezyum metalinin erimesiyle metal sadece fiziksel değişime uğrar. Maddenin kimyasal yapısında bir değişim gerçekleşmez. Bu nedenle magnezyum metalinin erimesi fiziksel bir olaydır.
2. LPG’nin yanması:
Yanma olaylarının hepsi maddenin kimyasal yapısında değişim meydana getirdiği için kimyasal değişimlerdir. Saf maddelerin ya da çözeltilerin elektrolizi, çürüme, küflenme vb. olaylar da yine kimyasal değişimdir. LPG’nin yanması kimyasal bir olaydır.
3. Yemek tuzunun suda çözünmesi:
Yemek tuzunun suda çözünmesi fiziksel bir olaydır. Tuz sadece suda erimiştir, tuzun kimyasal yapısında bir değişim meydana gelmez.
4. Sodyum metalinin suda çözünmesi:
Sodyum metalinin suda çözünmesiyle birlikte ortaya Sodyum Hidroksit (NaOH) ve hidrojen gazı (H) açığa çıkar. Bu maddeler yeni birer madde olduğu için sodyum metalinin suda çözünmesi kimyasal bir olaydır.
E) Aşağıdaki çoktan seçmeli soruları cevaplayınız.
1) C 2) E 3) D 4) E 5) E 6) B 7) D 8) D 9) E 10) E 11) C 12) B 13) B 14) D 15) D 16) E 17) A 18) C 19) C 20) A
Kaynak:Eğitim Sistem




Yorumların her türlü cezai ve hukuki sorumluluğu yazan kişiye aittir. Eğitim Sistem yapılan yorumlardan sorumlu değildir.